GRUPOS DE LA TABLA PERIÓDICA 7A,6A,5A,4A
GRUPOS DE LA TABLA PERIÓDICA 7A,6A,5A,4A
INTRODUCCIÓN
En esta entrada encontraremos toda la información sobre los grupos 4,5,6 y 7A, de la tabla periódica, con sus propiedades químicas, su ubicación en la tabla periódica, sus aplicaciones y algunos efectos ambientales que estos elementos químicos produces, uno como metales y no metales,sacando toda esta información de diferentes vídeos de youtube e información en la web
Los elementos que forman cada grupo tienen en general propiedades químicas símiles entre sí, aunque hay excepciones. Esto es debido a que todos coinciden en su configuración electrónica.
OBJETIVOS:
- Conocer los diferentes números de grupos de la sección A de la tabla periódica.
- Enumerar los elementos químicos pertenecientes a cada grupo con sus aplicaciones, ubicaciones y efectos ambientales.
- Distinguir cada uno con su respectiva imagen y definición.
MARCO TEÓRICO
ELEMENTOS DEL GRUPO IVA

Los elementos del grupo IVA son:
- carbono(C)
- silicio(si)
- germanio(ge)
- estaño(Sn)
- plomo(Pb)
- erristeneo(Eo)
Estos elementos forman más de la cuarta parte de la corteza terrestre y solo podemos encontrar en forma natural al carbono al estaño y al plomo en forma de óxidos y sulfuros, su configuración electrónica termina en ns2,p2.
Los elementos de este grupo presenta diferentes estados de oxidación y estos son: +2 y +4., los compuestos orgánicos presentan variedad en su oxidación mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfótero, el plomo es un elemento tóxico.
Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
En este grupo encontramos variedad en cuanto a sus características físicas y químicas de cada uno de los elementos de este grupo.
CARBONO(C):

El carbono es el 15.º elemento más abundante en la corteza terrestre y el cuarto elemento más abundante en el universo en masadespués del hidrógeno, el helio y el oxígeno. La abundancia de carbono, su diversidad única de compuestos orgánicos y su inusual capacidad para formar polímeros a las temperaturas comúnmente encontradas en la Tierra, permite que este elemento sirva como un elemento común de toda la vida conocida. Es el segundo elemento más abundante en el cuerpo humano en masa (aproximadamente el 18,5%) después del oxígeno.
Los átomos de carbono pueden unirse de diferentes maneras, denominadas alótropos del carbono, reflejo de las condiciones de formación. Los más conocidos que ocurren naturalmente son el grafito, el diamante y el carbono amorfo. Las propiedades físicas del carbono varían ampliamente con la forma alotrópica. Por ejemplo, el grafito es opaco y negro, mientras que el diamante es altamente transparente. El grafito es lo suficientemente blando como para formar una raya en el papel (de ahí su nombre, del verbo griego "γράφειν" que significa 'escribir'), mientras que el diamante es el material natural más duro conocido. El grafito es un buen conductor eléctrico mientras que el diamante tiene una baja conductividad eléctrica. En condiciones normales, el diamante, los nanotubos de carbono y el grafeno tienen las conductividades térmicas más altas de todos los materiales conocidos. Todos los alótropos del carbono son sólidos en condiciones normales, siendo el grafito la forma termodinámicamente estable. Son químicamente resistentes y requieren altas temperaturas para reaccionar incluso con oxígeno.

CARACTERÍSTICAS:
- El carbono es un elemento que posee formas alotrópicas, un caso fascinante lo encontramos en el grafito y en el diamante, el primero corresponde a uno de las sustancias más blandas y el segundo a uno de los elementos más duros y otro caso con el carbón y el diamante, el carbón es tienen un precio comercial bastante bajo en cambio el diamante es conocido por ser una de las piedras mas costosas del mundo.
- Presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples.
- Con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas, con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos.
- Carbono y diamante en forma alotrópica,estados alotrópicos: Se conocen cinco formas alotrópicas del carbono, una de las formas como encontramos el carbono es el grafito el grafito tienen exactamente la misma cantidad de átomos que el diamante la única variación que este presenta esta en la estructura la estructura del diamante es tetraédrica y la del grafito es mucho más sencilla. Pero por estar dispuestos en diferente forma, su textura, fuerza y color son diferentes.
USOS:
- El carbono presenta dos formas alotrópicas el carbono amorfo que es el grafito y el carbono cristalino que es el diamante. Ambos presentan usos bastantes importantes.
- El grafito se mezcla con la arcilla para elaborar las puntas de los lápices. Otra aplicación es como aditivo en lubricantes. También se emplea en la preparación de pinturas anti-radar usadas en el camuflaje de vehículos y aviones militares.
- Por su parte, el diamante se utiliza para la elaboración de joyas y como material de corte ya que este presenta una dureza 10 en la escala de Mohs.
- el carbono también se emplea en aleaciones para obtener acero. El acero es una mezcla de hierro con una cantidad de carbono variable entre el 0,03 % y el 2,14 % en masa de su composición, dependiendo del grado.
Gases: Empleados para combustible doméstico y de transporte.
Gasolinas: Usados como combustible para motores industriales y automóviles.
Querosén: Combustible de aviación.
Gas-oil: Usado como combustible en motores diesel.
Aceites lubricantes: Empleados en la industria química como engrasado de máquinas o explosivos.
Asfaltos: Para la pavimentación de carreteras.
Parafinas y carbón de coque: Empleados en altos hornos.
Vaselina: Utilizada para pomadas y ungüentos.
Otros subproductos son: alcoholes y bencenos utilizados en la elaboración de fibras textiles, plásticos, lacas, colorantes y disolventes.
SILICIO (Si)

Es un metaloide de número atómico 14 de grupo A4. El silicio es el segundo elemento más abundante de la corteza terrestre (27,7% en peso) Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico.
Silicio como base bioquímica[editar]
Sus características compartidas con el carbono, como estar en la misma familia 14, no ser metal propiamente dicho, poder construir compuestos parecidos a las enzimas (zeolitas), otros compuestos largos con oxígeno (siliconas) y poseer los mismos cuatro enlaces básicos, le confiere cierta oportunidad en llegar a ser base de seres vivos, aunque no sea en la Tierra, en una bioquímica hipotética.
CARACTERISTICAS:
- En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo.
- Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos.
- El silicio transmite más del 95% de las longitudes de onda de la radiación infrarroja. Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos.
- Se obtiene calentando sílice, o dióxido de silicio (SiO2), el silicio cristalino tiene una dureza de 7, suficiente para rayar el vidrio, de dureza de 5 a 7.
- El silicio tiene un punto de fusión de 1.411 °C, un punto de ebullición de 2.355 °C y una densidad relativa de 2,33(g/ml). Su masa atómica es 28,086 u

USOS:
- Se utiliza en aleaciones, en la preparación de las siliconas, en la industria de la cerámica técnica y, debido a que es un material semiconductor muy abundante, tiene un interés especial en la industria electrónica y microelectrónica como material básico para la creación de obleas o chips que se pueden implantar en transistores, pilas solares y una gran variedad de circuitos electrónicos.
- El silicio es un elemento vital en numerosas industrias.
- El silicio también se emplea ampliamente en aleaciones con el aluminio para elaborar piezas fundidas. Dichas se emplean habitualmente en la industria automovilística para producir piezas para autos.
GERMANIO(Ge)

Elemento químico, metálico, gris plata, quebradizo, símbolo Ge, número atómico 32, peso atómico 72.59, punto de fusión 937.4ºC (1719ºF) y punto de ebullición 2830ºC (5130ºF), con propiedades entre el silicio y estaño.
El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millón (ppm). El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales.
CARACTERÍSTICAS:
- Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias.
- Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis. Forma gran número de compuestos organometálicos y es un importante material semiconductor utilizado en transistores y fotodetectores.
- A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
- Las aplicaciones del germanio se ven limitadas por su elevado costo y en muchos casos se investiga su sustitución por materiales más económicos Fibra óptica.
- Electrónica: radares y amplificadores de guitarras eléctricas usados por músicos nostálgicos del sonido de la primera época del rock and roll; aleaciones SiGe en circuitos integrados de alta velocidad.
- También se utilizan compuestos sandwich Si/Ge para aumentar la movilidad de los electrones en el silicio (streched silicon).
- Óptica de infrarrojos: Espectroscopios, sistemas de visión nocturna y otros equipos. Lentes, con alto índice de refracción, de ángulo ancho y para microscopios.
- En joyería se usa la aleación Au con 12% de germanio.
- Los cristales de germanio al mezclarse con elementos como fosforo, arsénico, antimonio, boro, aluminio y galio se comportan como rectificadores y por lo tanto es empleado desde la segunda guerra mundial como detectores para ultra alta frecuencia (UHF) en señales de radar y radio. Estos cristales también son utilizados como transistores y diodos.
ESTAÑO(Sn)

El estaño se conoce desde antiguo: en Mesopotamia se hacían armas de bronce, Plinio menciona una aleación de estaño y plomo, los romanos recubrían con estaño el interior de recipientes de cobre.
Representa el 0,00023% en peso de la corteza. Raramente se encuentra nativo, siendo su principal mineral la casiterita (SnO2). También tiene importancia la estannita o pirita de estaño. La casiterita se muele y enriquece en SnO2 por flotación, éste se tuesta y se calienta con coque en un horno, con lo que se obtiene el metal.
Para purificarlo (sobre todo de hierro) se eliminan las impurezas subiendo un poco por encima de la temperatura de fusión del estaño, con lo que éste sale en forma líquida.
CARACTERÍSTICAS:
- Es un metal, maleable, que no se oxida y es resistente a la corrosión.
- Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiendolos de la corrosión.
- Una de sus características más llamativas es que bajo determinadas condiciones forma la peste del estaño.
- Estaño casi en polvo Formas alotrópicas: El estaño puro tiene dos variantes alotrópicas: El estaño gris, polvo no metálico, conductor, de estructura cúbica y estable a temperaturas inferiores a 13,2 °C, que es muy frágil y tiene un peso específico más bajo que el blanco.
- En baja y en alta es un opacificante.
- En alta la proporción del porcentaje es más alto que en baja temperatura.
- Se usa como revestimiento protector del cobre, del hierro y de diversos metales usados en la fabricación de latas de conserva.
- También se usa para disminuir la fragilidad del vidrio. Los compuestos de estaño se usan para fungicidas, tintes, dentífricos (SnF2) y pigmentos.
- Se usa para hacer bronce, aleación de estaño y cobre. Se usa para la soldadura blanda, aleado con plomo. Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales.
- En etiquetas.
- Recubrimiento de acero.
- Se usa como material de aporte en soldadura blanda con cautín, bien puro o aleado. La directiva RoHS prohíbe el uso de plomo en la soldadura de determinados aparatos eléctricos y electrónicos.
- El estaño también se utiliza en la industria de la cerámica para la fabricación de los esmaltes cerámicos.

PLOMO (Pb)

Es un elemento de la tabla periódica, cuyo símbolo es Pb y su número atómico es 82 Dmitri Mendeléyev químico no lo reconocía como un elemento metálico común por su gran elasticidad molecular.
Cabe destacar que la elasticidad de este elemento depende de las temperaturas del ambiente, las cuales distienden sus átomos, o los extienden.
El plomo es un metal de densidad relativa 11,45 a 16 °C tiene una plateada con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, in-elástico y se funde con facilidad. Su fusión se produce a 326,4 °C y hierve a 1745 °C. Las valencias químicas normales son 2 y 4.
CARACTERÍSTICAS:
- Los compuestos de plomo más utilizados en la industria son los óxidos de plomo, el tetraetilo de plomo y los silicatos de plomo.
- Una de las características del plomo es que forma aleaciones con muchos metales como el calcio estaño y bronce, y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones.
- Es un metal pesado y tóxico, y la intoxicación por plomo se denomina saturnismo o plumbosis.
- Es un metal pesado y tóxico, y la intoxicación por plomo se denomina como saturnismo o plumbosis.
- se obtiene a partir de los sulfuros minerales; el cual, tras un previo enriquecimiento es tostado y sinterizado en un horno, obteniéndose así el óxido de plomo (II), el cual se reduce con carbón de coque a plomo metal impuro (plomo de obra).
- El plomo se purifica por métodos pirometalúrgicos o electrolíticos
- El plomo se usa como cubierta para cables, ya sea la de teléfono, de televisión, de Internet o de electricidad, sigue siendo una forma de empleo adecuada.
- La ductilidad única del plomo lo hace particularmente apropiado para esta aplicación, porque puede estirarse para formar un forro continuo alrededor de los conductores internos.
- Se utilizan una gran variedad de compuestos de plomo, como los silicatos, los carbonatos y sales de ácidos orgánicos, como estabilizadores contra el calor y la luz para los plásticos de cloruro de polivinilo.
- Se usan silicatos de plomo para la fabricación de frituras (esmaltes) de vidrio y de cerámica, las que resultan útiles para introducir plomo en los acabados del vidrio y de la cerámica.
- La asida de plomo, Pb(N3)2, es el detonador estándar para los explosivos plásticos como el C-4. Los arseniatos de plomo se emplean en grandes cantidades como insecticidas para la protección de los cultivos y para ahuyentar insectos molestos como lo son cucarachas, mosquitos y otros animales que poseen un exoesqueleto.
FLEROVIO (Fl)
Flerovio (anteriormente llamado Ununquadio, Uuq o Erristeneo, Eo)4 es el nombre de un elemento químico radiactivo con el símbolo Fl y número atómico 114. Nombrado en honor a Gueorgui Fliórov.5
 Hasta la fecha se han observado alrededor de 80 desintegraciones de átomos de flerovio, 50 de ellas directamente y 30 de la desintegración de los elementos más pesados Livermorio y Oganesón. Todas las desintegraciones han sido asignados a los cuatro isótopos vecinos con números de masa 286-289. El isótopo de más larga vida conocido actualmente es el 289Fl114 con una vida media de aproximadamente 2,6 s, aunque hay evidencias de un isómero, 289bFl114, con una vida media de aproximadamente 66 s, que sería uno de los núcleos más longevos en la región de los elementos superpesados.
Hasta la fecha se han observado alrededor de 80 desintegraciones de átomos de flerovio, 50 de ellas directamente y 30 de la desintegración de los elementos más pesados Livermorio y Oganesón. Todas las desintegraciones han sido asignados a los cuatro isótopos vecinos con números de masa 286-289. El isótopo de más larga vida conocido actualmente es el 289Fl114 con una vida media de aproximadamente 2,6 s, aunque hay evidencias de un isómero, 289bFl114, con una vida media de aproximadamente 66 s, que sería uno de los núcleos más longevos en la región de los elementos superpesados.
 Experimentos químicos muy recientes han indicado fuertemente que el elemento 114 no posee propiedades 'eka'-plomo y parece comportarse como el primer elemento superpesado, que presenta propiedades similares a los gases nobles debido a efectos relativistas.6Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.
Experimentos químicos muy recientes han indicado fuertemente que el elemento 114 no posee propiedades 'eka'-plomo y parece comportarse como el primer elemento superpesado, que presenta propiedades similares a los gases nobles debido a efectos relativistas.6Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.


ELEMENTOS DEL GRUPO VA

El grupo VA del Sistema Periódico, o familia del nitrógeno, está formado por los elementos: nitrógeno, fósforo, arsénico, antimonio y bismuto. Debido a su configuración electrónica, estos elementos no tienden a formar compuestos iónicos, más bien forman enlaces covalentes.
El carácter metálico aumenta considerablemente conforme se desciende en el grupo, siendo el nitrógeno y el fósforo no-metales, el arsénico y el antimonio semimetales y el bismuto un metal.
A este grupo pertenecen los elemntos:
- Nitrogeno (N)
- Fosforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
Dentro de cualquier familia A de la clasificación periódica, la característica metálica aumenta al aumentar el número atómico. Es muy notable en el grupo VA.Las primeras energías de ionización disminuyen desde los valores típicos de un no metal para el nitrógeno hasta los valores característicos de un metal para el bismuto. Así, el nitrógeno y el fósforo son no metales, al arsénico y al antimonio se les considera semimetales, y el bismuto es un metal. Aunque del fósforo al bismuto las energías de ionización cambian poco de un elemento al siguiente mientras que las energías de ionización del nitrógeno son mucho mayores que las del fósforo, tanto las energías de ionización como las electronegatividades y los radio iónicos y covalentes varían en el orden esperado al bajar en el grupo.
NITRÓGENO (N)

CARACTERÍSTICAS:
- Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión.
- En estado combinado, el nitrógeno se presenta en diversas formas.
- Es constituyente de todas las proteínas (vegetales y animales), así como también de muchos materiales orgánicos.
- Su principal fuente mineral es el nitrato de sodio.
- Los usos de los nitruros de los metales reflejan sus propiedades: tienen altos puntos de fusión, son muy duros, químicamente inertes y conductores eléctricos.
USOS:
- La mayor parte del nitrógeno se utiliza en la formación de amoniaco. Además, el nitrógeno liquido se utiliza extensamente en criogenia para alcanzar bajas temperaturas y como gas para crear atmósferas inertes.
- Obtención de fertilizantes.
- Se usa en pequeñas cantidades en lámparas.
- Es componente básico del ácido nítrico, amoniaco, ciámidos, tintes, compuestos de colado o de plásticos derivados de la urea. cianuros y nitruros para cubiertas endurecedoras de metales y numerosos compuestos orgánicos sintéticos y otros nitrogenados.
- También se le utiliza en la preparación de atmósferas inertes (en procesos químicos y metalúrgicos que deben efectuarse en ausencia de oxígeno, y en la elaboración y empacado de alimentos para evitar su descomposición por exposición al oxígeno atmosférico) y como líquido criogénico y refrigerante.
- Se usa para la fabricación de materiales refractarios, abrasivos, instrumentos para moler y cortar, y semiconductores.
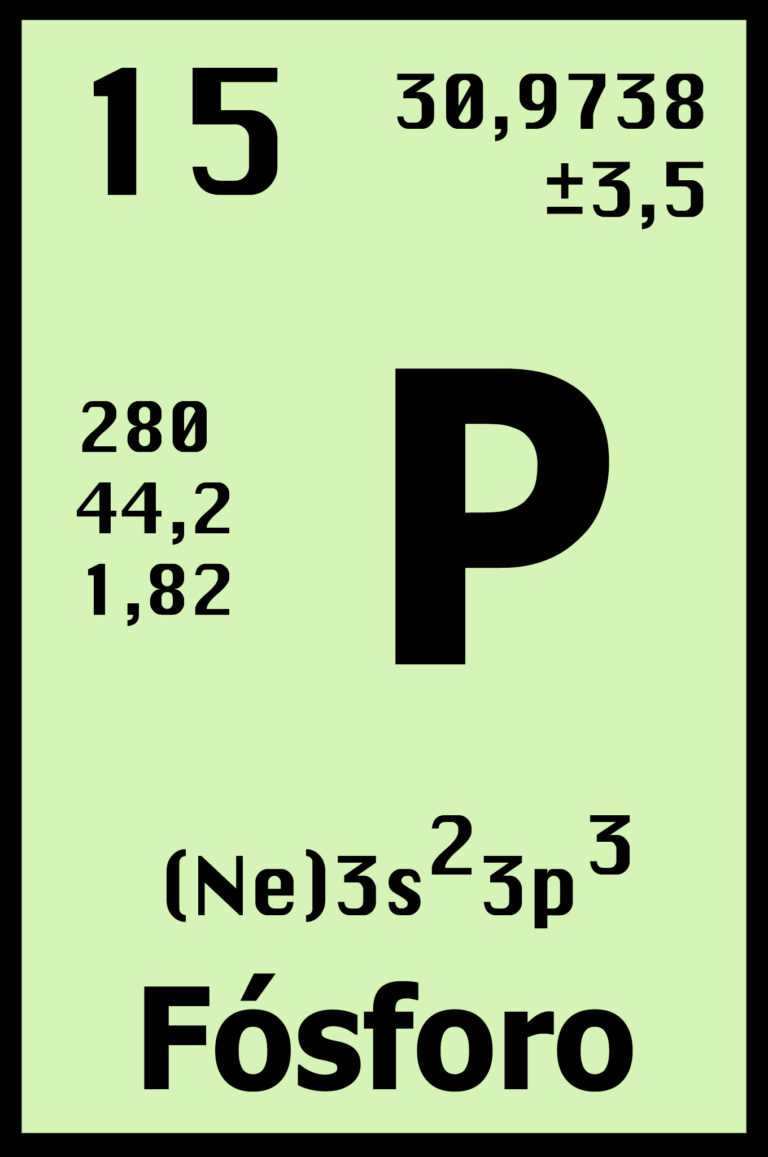
FÓSFORO (P)

Existen 3 formas alotrópicas más importantes que son: blanco, negro y rojo.
- Fósforo blanco: Es muy venenoso, insoluble en agua pero soluble en benceno y sulfuro de carbono. Es una sustancia muy reactiva, su inestabilidad tiene su origen en el ángulo de 60º de las unidades P4. Es la más reactiva de todas las formas alotrópicas.
- Fósforo negro: Es cinéticamente inerte y no arde al aire incluso a 400°C.
- Fósforo rojo: No es venenoso, insoluble en todos los disolventes y arde al aire por encima de los 400°C. Reacciona con los halógenos con menor violencia. Tiene una estructura polimérica con tetraedros P4 unidos entre sí.
CARACTERÍSTICAS:
- Debido a su fragilidad, los no metales como el fósforo, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
- El estado del fósforo en su forma natural es sólido (diamagnético).
- El fósforo es un elmento químico de aspecto incoloro, rojo o blanco plateado y pertenece al grupo de los no metales.
- El número atómico del fósforo es 15. El símbolo químico del fósforo es P.
- El punto de fusión del fósforo es de 317,3 grados Kelvin o de 45,15 grados celsius o grados centígrados.
- El punto de ebullición del fósforo es de 550 grados Kelvin o de 277,85 grados celsius o grados centígrados.
USOS:
- Los fosfatos se utilizan para hacer vidrio especial que se utiliza como en las lámparas de sodio.
- El fósforo es un nutriente esencial para las plantas, por lo que se añade a los fertilizantes.
- En el laboratorio, dos isótopos radiactivos de fósforo se puede utilizar como trazadores radiactivos.
- El fosfato de calcio se puede utilizar para hacer porcelana fina.
- Las cabezas de las cerillas están hechos de fósforo. Las bengalas y los fósforos de seguridad también están hechos de fósforo.
- El fósforo blanco se usa en bombas incendiarias, cortinas de humo (por ejemplo, bombas de humo) y en munición trazadora.
- El tributilfosfato, un compuesto de fósforo, se utiliza para extraer uranio. Esto se llama el proceso Purex.
- El fósforo es un componente importante de ADN y ARN.
- El fósforo se utiliza en la producción de acero.
- El tripolifosfato de sodio se utiliza en detergentes para ropa en algunas partes del mundo. Esto ayuda en la limpieza de la ropa. Sin embargo, algunos países han prohibido ya que conduce a la muerte de los peces cuando se filtró hacia las vías fluviales.
- Otros compuestos de fósforo se utilizan en la fabricación de pesticidas, aditivos alimentarios, dentífrico y fertilizantes.
ARSENICO (As)

CARACTERÍSTICAS:
- Tiene propiedades a la vez metálicas y no metálicas. Se sublima a 450 °C, sin fundir, dando vapores amarillos.
- El arsénico amarillo, por la acción de la luz, pasa a la forma parda y finalmente, a la gris.
- El arsénico metálico arde a 180 °C desprendiendo un olor a ajo muy característico, que permite reconocer hasta tazas de arsénico.
- El arsénico es un metal de color gris de plata, extremadamente frágil y cristalizado que se vuelve negro al estar expuesto al aire.
- Es inadecuado para el uso común de los metales dada su toxicidad (extremadamente venenoso). es considerado como un elemento perjudicial en las aleaciones, ya que tiende a bajar el punto de fusión y a causar fragilidad.
- El arsénico forma parte de los elementos denominados metaloides o semimetales. Este tipo de elementos tienen propiedades intermedias entre metales y no metales.
- En cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el arsénico, son semiconductores.
- El estado del arsénico en su forma natural es sólido.
- El punto de fusión del arsénico es de 887 grados Kelvin o de 614,85 grados celsius o grados centígrados.
- El punto de ebullición del arsénico es de 1090 grados Kelvin o de 817,85 grados celsius o grados centígrados.
USOS:
- El arsénico se usa en aleaciones no ferrosas para aumentar la dureza de las aleaciones de plomo facilitando la fabricación de perdigones
- Se aplica en la elaboración de insecticidas ( arseniato de calcio y plomo), herbicidas, raticidas y fungicidas
- Fabricación de vidrio, textiles, papeles, adhesivos de metal, preservantes de alimentos, procesos de bronceado y conservación de pieles
- El arsénico de máxima pureza se utiliza para la fabricación de semiconductores
- Se aplica en la elaboración de insecticidas ( arseniato de calcio y plomo), herbicidas, raticidas y fungicidas
- Se utiliza como colorantes de algunas pinturas y papeles en cerámicas y vidriería..
- Se usa en la industria de la pirotecnia para la preparación de bengalas.
- El uso principal de arsénico metálico es el fortalecimiento de las aleaciones de cobre y plomo para su uso en baterías de coche.
- También se utiliza como un dopante de tipo n en dispositivos semiconductores electrónicos (como los diodos).
- El arsénico también se utiliza en numerosos pesticidas, herbicidas e insecticidas, aunque esta práctica se está volviendo menos común ya que cada vez más productos de este tipo están prohibidos.
- Se ha utilizado como un conservante de madera debido a su toxicidad para los insectos, bacterias y hongos.
- El arsénico se añade a los alimentos de animales para prevenir enfermedades y favorecer su crecimiento.
- El arsénico se utiliza en el tratamiento médico del cáncer, tales como la leucemia promielocítica aguda.
- El arsénico-74 un isótopo se utiliza como una forma de localizar tumores en el cuerpo. Se produce imágenes más claras que utilizando yodo.
- El arsénico se añade en pequeñas cantidades a la alfa latón para hacerlo resistente a la lixiviación de zinc. Este tipo de latón se utiliza para hacer accesorios de fontanería u otros artículos que están en contacto constante con el agua.
ANTIMONIO(Sb)

El antimonio es un elemento químico de aspecto gris plateado con número atómico 51. Su símbolo es Sb y pertenece al grupo de los metaloides y su estado habitual en la naturaleza es sólido. El antimonio está situado en la posición 51 de la tabla periódica.
CARACTERISTICAS:
- El antimonio no es un elemento abundante en la naturaleza, muy rara vez se encuentra en forma natural y con frecuencia se encuentra como una mezcla isomorfa con arsénico (allemonita).
- Su símbolo Sb se obtiene de la palabra Stibium.
- Es duro, frágil y cristalizado que no es ni maleable ni dúctil.
- Se encuentra en dos formas: amarilla y gris.
- La forma amarilla es metaestable y se compone de moléculas Sb4, la forma gris es metálica, la cual cristaliza en capas formando una estructura romboédrica.
- El antimonio tiene una conductividad eléctrica menos en estado sólido que en estado líquido lo cual lo hace diferente a los metales normales, en forma metálica es muy quebradizo, de color blanco-azuloso con un brillo metálico característico, de apariencia escamosa.
- El antimonio se obtiene calentando el sulfuro con hierro, o calentando el sulfuro y el sublimado Sb4O6 obtenido se reduce con carbono.
- El antimonio de alta pureza se produce por refinado electrolítico.
USOS:
- Producción de diodos, detectores infrarrojos y dispositivos de efecto Hall.
- Es usado como un aleante, ya que incrementa mucho la dureza y resistencia a esfuerzos mecánicos de la aleación. Aleaciones como Peltre, metal antifricción (con estaño), etc.
- Baterías, acumuladores, recubrimiento de cables, cojinetes y rodamientos.
- Sus compuestos en forma de óxidos se utilizan para la fabricación de materiales resistentes al fuego, tales como: esmaltes, vidrios, pinturas y cerámicos.
- El más importante de los compuestos en forma de óxido es el trióxido de antimonio el cual se usa principalmente como retardante de llama.
BISMUTO (Bi)

CARACTERÍSTICAS:
- El bismuto pertenece al grupo de elementos metálicos conocido como metales del bloque p que están situados junto a los metaloides o semimetales en la tabla periódica.
- Este tipo de elementos tienden a ser blandos y presentan puntos de fusión bajos, propiedades que también se pueden atribuir al bismuto, dado que forma parte de este grupo de elementos.
- El estado del bismuto en su forma natural es sólido.
- El bismuto es un elmento químico de aspecto rojo, blanco brillante y pertenece al grupo de los metales del bloque p. El número atómico del bismuto es 83.
- El símbolo químico del bismuto es Bi.
- El punto de fusión del bismuto es de 544,4 grados Kelvin o de 272,25 grados celsius o grados centígrados.
- El punto de ebullición del bismuto es de 1837 grados Kelvin o de 1564,85 grados celsius o grados centígrados.
- Se encuentra naturalmente como metal libre y en minerales, sus principales depósitos se encuentran en suramerica, aunque en norteamerica se obtiene como subproducto del refinado de minerales de plomo y cobre.
USOS:
- Manufactura de compuestos farmacéuticos.
- Manufactura de aleaciones de bajo punto de fusión.
- Se utiliza en rociadoras automáticas, sellos de seguridad para cilindros de gas comprimido, soldaduras especiales.
- Las aleaciones que se expanden al congelarse se usan en fundición y tipos metálicos.

A este grupo pertenecen los siguientes elementos:
- Oxígeno (O)
- Azufre (S)
- Selenio (Se)
- Telurio (Te)
- Polonio (Po)
- Livermorio (Lv).
OXIGENO (O)

CARACTERÍSTICAS:
- Es uno de los elementos que, en condiciones de presión y temperatura ordinarios, se encuentra en estado gaseoso.
- Es un elemento no metálico, muy electronegativo.
- Es el principal de los anfígenos (formadores de ácidos y bases) y sus estados de oxidación son de -2 y -1 (recibe electrones).
- El oxígeno posee tres isótopos naturales y estables: 16O, 17O y 18O, siendo el primero el más abundante (99,762%).
- En todas sus presentaciones es una sustancia inflamable y muy reactiva, que en contacto con metales forma óxidos y corroe las superficies.
- El oxígeno en condiciones ordinarias se manifiesta como un gas incoloro, inodoro e insípido.
- Es sumamente combustible y mucho más soluble que el nitrógeno: el agua dulce contiene alrededor de 6,04ml de oxígeno por litro, mientras que el agua marina contiene 4,95ml por litro.
- El oxígeno es fundamental en la vida como la conocemos, en primer lugar, porque forma parte de los azúcares y proteínas que componen las sustancias esenciales biológicas.
- constituye las moléculas esenciales del metabolismo de obtención de energía de los seres vivos.
USOS:
- El oxígeno se emplea como gas respirable en el mantenimiento con vida de pacientes quirúrgicos y como terapia (oxigenoterapia) para pacientes de afecciones cardíacas, pulmonares, etc. Ciertos isótopos sintéticos como el 15O se usan para tomografías positrónicas.
- En las misiones espaciales, submarinas y similares, el oxígeno gaseoso a baja presión se emplea como gas respirable, para sostener los niveles de habitabilidad de trajes, naves y habitáculos.
- 55% del oxígeno producido en el mundo entero en laboratorios se destina a la producción de aleaciones del hierro como el acero. Otro 25% se destina a la industria química, para crear óxido de etileno (C2H4O), base para la fabricación de numerosos materiales textiles y plásticos. Finalmente, se emplea también oxígeno para quemar acetileno y fabricar sopletes capaces de cortar metal con suma rapidez.
- El oxígeno sirve también para oxidar el combustible de cohetes, para tratamiento de aguas residuales o, como ozono (O3) para purificadores de agua.
AZUFRE (S)

El azufre es un elemento químico, clasificado dentro del grupo de los no metales, se encuentra de manera abundante en la naturaleza, con olor característico a huevo podrido, se presenta en color amarillo limón fuerte, amarronado o anaranjado, es insoluble en agua pero es soluble en disulfuro de carbono, flamea con llama de color azul emitiendo dióxido de azufre.
CARACTERÍSTICAS:
- Se caracteriza por no tener brillo o lustre, no refleja la luz y en su estado natural se presenta en color amarillo limón.
- Su consistencia es sólida pero blanda y quebradiza.
- Es mal conductor del calor y aislante de la electricidad.
- Su punto de fusión es relativamente bajo.
- El azufre sólido se conforma de una estructura molecular de anillos disformes de ocho átomos y adopta una de dos formas cristalinas
- Al elevar la temperatura se convierte en un líquido fluido y amarillo transparente, que presenta cambios en sus propiedades y estructura, el color se vuelve pardo y espeso y vuelve a aclarase cuando llega al punto de ebullición, convirtiéndose en un líquido rojo y viscoso.
- En la fase gaseosa a los 780 °C adopta una forma equilibrada de mezcla de moléculas ortorrómbicas y prismamonoclínicas; sobre los 1800 °C la separación molecular es completa y se encuentran átomos de azufre.
USOS:
- La mayor parte se destina a la producción del ácido sulfúrico, uno de los productos químicos más importantes, utilizado a su vez en la producción de fertilizantes a partir de fosfatos y amoníaco.
- También se emplea en la vulcanización del caucho, fabricación de jabón, detergentes, cementos, aislantes eléctricos, plásticos, explosivos, blanqueadores, tintes, drogas, pinturas, papel y la refinación del petróleo.
- calma la piel, ideal para tratar eczemas y reacciones alérgicas cutáneas.
- Elimina las toxinas, incorporándose principalmente en productos antiacné y antigrasa.
SELENIO (Se)

CARACTERÍSTICAS:
- Una de las propiedades de los elementos no metales como el selenio es por ejemplo que los elementos no metales son malos conductores del calor y la electricidad.
- El selenio, al igual que los demás elementos no metales, no tiene lustre.
- Debido a su fragilidad, los no metales como el selenio, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
- El estado del selenio en su forma natural es sólido.
- El selenio es un elmento químico de aspecto gris metálico y pertenece al grupo de los no metales. El número atómico del selenio es 34.
- El punto de fusión del selenio es de 494 grados Kelvin o de 221,85 grados celsius o grados centígrados.
- El punto de ebullición del selenio es de 957,8 grados Kelvin o de 685,65 grados celsius o grados centígrados.

USOS:
- El uso más común de selenio es en la producción de vidrio. Debido al hecho de que el selenio provoca un color rojo en el vidrio, también se puede usar para tintar el vidrio de color rojo. También se puede utilizar para anular los tintes de color verde o amarillo causados por otras impurezas durante el proceso de fabricación de vidrio.
- En la fabricación de goma se utilizan pequeñas cantidades de compuestos de selenio.
- El selenio se puede mezclar con otro elemento químico llamado bismuto para crear un latón sin plomo.
- El sulfuro de selenio es un ingrediente común de champú anticaspa que mata el hongo que causa la escamación del cuero cabelludo. También se puede usar para tratar ciertos problemas de la piel causados por otros hongos.
- Hace tiempo, el selenio se utilizaba mucho en la electrónica, pero se ha reducido su uso para este propósito en los últimos años. Todavía se utiliza en las células solares, fotocopiadoras y medidores de luz. También se utiliza en los diodos LED de color azul y blanco.
- El selenio se usa en algunas cámaras de rayos x. También se utiliza para las fotografías en blanco y negro.
TELURIO (Te)

El telurio es un elemento químico de aspecto gris plateado con número atómico 52. Su símbolo es Te y pertenece al grupo de los metaloides y su estado habitual en la naturaleza es sólido. El telurio está situado en la posición 52 de la tabla periódica.
El telurio es un elemento localizado dentro del grupo de los semi metales, de aspecto brillante, cristalino, frágil y con un color característico blanco plateado. Por lo general, lo podemos encontrar disponible como un polvo gris de color oscuro. Este es un elemento que tiene las propiedades tanto de los metales como las propiedades de los no metales. El telurio forma muchos compuestos que corresponden a los del azufre y el selenio. Cuando se quema en el aire, el teluro produce una llama de color azul verdosa y como resultado produce dióxido de telurio. El telurio no se ve afectado por el agua o el ácido clorhídrico, pero sí puede ser disuelto en ácido nítrico.
CARACTERÍSTICAS:
- El telurio forma parte de los elementos denominados metaloides o semimetales.
- Este tipo de elementos tienen propiedades intermedias entre metales y no metales.
- En cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el telurio, son semiconductores.
- El estado del telurio en su forma natural es sólido (no-magnético).
- El telurio es un elmento químico de aspecto gris plateado y pertenece al grupo de los metaloides.
- El punto de fusión del telurio es de 722,66 grados Kelvin o de 450,51 grados celsius o grados centígrados.
- El punto de ebullición del telurio es de 1261 grados Kelvin o de 988,85 grados celsius o grados centígrados.
USOS:
- Es utilizado a menudo como un aditivo para el acero y por lo general se alea al aluminio, cobre, plomo o estaño.
- También se agrega al plomo para lograr mejorar su durabilidad y resistencia ante la corrosión.
- Cuando se agrega al caucho, tiene la capacidad de acelerar el proceso de curado y hace que el producto sea menos susceptible al envejecimiento y menos propenso a verse afectado por el aceite, que suaviza el caucho normal.
- Principalmente se utiliza en la industria electrónica, por sus propiedades conductivas, en la fabricación de discos compactos y en dispositivos termoeléctricos.
- En las máquinas de acero y de cobre y en la coloración de los vidrios.
POLONIO (Po)

El polonio es un elemento químico de aspecto plateado con número atómico 84. Su símbolo es Po y pertenece al grupo de los metaloides y su estado habitual en la naturaleza es sólido. El polonio está situado en la posición 84 de la tabla periódica.
CARACTERÍSTICAS:
- El polonio forma parte de los elementos denominados metaloides o semimetales. Este tipo de elementos tienen propiedades intermedias entre metales y no metales.
- En cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el polonio, son semiconductores.
- El estado del polonio en su forma natural es sólido (no magnético).
- El polonio es un elmento químico de aspecto plateado y pertenece al grupo de los metaloides.
- El punto de fusión del polonio es de 527 grados Kelvin o de 254,85 grados celsius o grados centígrados.
- El punto de ebullición del polonio es de 1235 grados Kelvin o de 962,85 grados celsius o grados centígrados.
- En estado natural, el polonio es muy difícil de encontrar, pero no imposible.
- Comúnmente, el polonio se consigue mediante el bombardeo natural del bismuto con neutrones, de donde se extrae la matriz del polonio.
- Por los altísimos peligros que implica su gran radiactividad, el polonio es un elemento muy poco utilizado en las actividades humanas.
USOS:
- Su uso más común es en dispositivos para eliminar la electricidad estática de productos textiles y en cepillos para limpiar el polvo de películas fotográficas.
- Por otra parte, también se emplea en satélites espaciales, como una fuente de calor de peso ligero, ya que apenas una pequeña cantidad de este elemento es capaz de generar elevadas temperaturas y grandes cantidades de energía.
LIVERMORIO (Lv)

CARACTERÌSTICAS:
- El livermorio es un metal superpesado y radiactivo que no se puede encontrar en la naturaleza debido a la corta vida media de sus isótopos, por lo cual sólo puede obtenerse sintéticamente al bombardear otro elemento con partículas alfa.
- A una temperatura ambiente (20 °C), este elemento se encuentra en estado sólido, al igual que la mayoría de los elementos superpesados (con la notable excepción del flerovio y el copernicio).
- En la actualidad se conocen cinco radioisótopos del livermorio, los cuales tienen masas atómicas que van desde el número 290 hasta el 294.
- De todos estos, el más estable es el livermorio-294, con una vida media de tan solo 54 milisegundos.
- El livermorio no tiene una función biológica determinada y es tóxico para el cuerpo humano por su radiactividad.
- Debido a su escasez, al coste de su producción, a su corta vida media de sus isótopos y a su radiactividad, el livermorio no tiene aplicaciones más allá de la investigación científica.
ELEMENTOS DEL GRUPO VII A

Tienen las energías de ionización más elevadas y en consecuencia son los elementos más electronegativos.
Reaccionan fácilmente con los metales formando sales, rara vez están libres en la naturaleza, todos son gaseosos a temperatura ambiente menos el bromo que es líquido en condiciones ambientales normales.
Su característica química más fundamental es su capacidad oxidante porque arrebatan electrones de carga y moléculas negativas a otros elementos para formar aniones.
A este grupo pertenecen los siguientes elementos:
- Fluor (F)
- Cloro (Cl)
- Bromo (Br)
- yodo (Y)
- Astato(At)
FLUOR (F)

Símbolo F, número atómico 9, miembro de la familia de los halógenos con el número y peso atómicos más bajos. Aunque sólo el isótopo con peso atómico 19 es estable, se han preparado de manera artificial los isótopos radiactivos, con pesos atómicos 17 y 22, el flúor es el elemento más electronegativo, y por un margen importante, el elemento no metálico más energético químicamente.
CARACTERISTICAS:
- El flúor elemental es un gas de color amarillo pálido a temperaturas normales.
- El olor del elemento es algo que está todavía en duda. La reactividad del elemento es tan grande que reacciona con facilidad, a temperatura ambiente, con muchas otras sustancias elementales, entre ellas el azufre, el yodo, el fósforo, el bromo y la mayor parte de los metales.
- Dado que los productos de reacción con los no metales son líquidos o gases, las reacciones continúan hasta consumirlo por completo, con frecuencia con producción considerable de calor y luz.
- En las reacciones con los metales forma un fluoruro metálico protector que bloquea una reacción posterior a menos que la temperatura se eleve. El aluminio, el níquel, el magnesio y el cobre forman tales películas de fluoruro protector.
- El flúor reacciona con violencia considerable con la mayor parte de los compuestos que contienen hidrógeno, como el agua, el amoniaco y todas las sustancias orgánicas, sean líquidos, sólidos o gases. La reacción del flúor con el agua es compleja y produce principalmente fluoruro de hidrógeno y oxígeno, así como cantidades menores de peróxido de hidrógeno, difluoruro de oxígeno y ozono.
- El flúor desplaza otros elementos no metálicos de sus compuestos, aun aquellos muy cercanos en cuanto a actividad química.
- Desplaza el cloro del cloruro de sodio y el oxígeno en la sílica, en vidrio y en algunos materiales cerámicos.
- En ausencia de fluoruro de hidrógeno, el flúor no ataca en forma significativa al cuarzo o al vidrio, ni aun después de varias horas a temperaturas hasta de 200ºC (390ºF).
USOS:
- Los compuestos que contienen flúor se utilizan para incrementar la fluidez del vidrio fundido y escorias en la industria vidriera y cerámica.
- El espato flúor (fluoruro de calcio) se introduce dentro del alto horno para reducir la viscosidad de la escoria en la metalurgia del hierro.
- La criolita, Na2AlF6, se utiliza para formar el electrólito en la metalurgia del aluminio.
CLORO (CL)

Elemento químico, símbolo Cl, de número atómico 17 y peso atómico 35.453. El cloro existe como un gas amarillo-verdoso a temperaturas y presiones ordinarias. Es el segundo en reactividad entre los halógenos, sólo después del flúor, y de aquí que se encuentre libre en la naturaleza sólo a las temperaturas elevadas de los gases volcánicos. Se estima que 0.045% de la corteza terrestre es cloro. Se combina con metales, no metales y materiales orgánicos para formar cientos de compuestos.
CARACTERISTICAS:
- El cloro presente en la naturaleza se forma de los isótopos estables de masa 35 y 37; se han preparado artificialmente isótopos radiactivos.
- El cloro es uno de los cuatro elementos químicos estrechamente relacionados que han sido llamados halógenos. El flúor es el más activo químicamente; el yodo y el bromo son menos activos.
- El cloro reemplaza al yodo y al bromo de sus sales. Interviene en reacciones de sustitución o de adición tanto con materiales orgánicos como inorgánicos.
- El cloro seco es algo inerte, pero húmedo se combina directamente con la mayor parte de los elementos.
USOS:
- El cloro es utilizado comúnmente para eliminar las bacterias en piscinas y para potabilizar el agua para consumo humano, ya que se ha comprobado que es bastante efectivo para combatir bacterias como la E. coli.
- También es usado en desinfectantes de uso doméstico y para blanquear la ropa.
- Otro de sus usos es en la fabricación de plásticos como el PVC, que es cloruro de polivinilo, el cual es empleado en la fabricación de tubos flexibles, cables, prendas de vestir, estructuras inflables y hasta en la fabricación de tejas para los techos de casas y edificios.
- En su forma de cloruro de metilo, es usado como anestésico, en la elaboración de tubos de silicón y en la extracción de resinas, aceites y grasas.
- Otro derivado del cloro, es el cloroformo, el cual es usado para matar gusanos en heridas de animales, también como disolvente en los laboratorios.
BROMO(Br)

Lugar de descubrimiento: Francia.
Año de descubrimiento: 1826.
Origen del nombre: De la palabra griega "brómos" que significa "fetidez", debido al fuerte y desagradable olor de este elemento, sobre todo de sus vapores.
Efecto Ambiental: Los bromuros orgánicos son a menudo aplicados como agentes desinfectantes y protectores, debido a sus efectos perjudiciales para los microorganismos. Cuando se aplican en invernaderos y en campos de cultivo pueden ser arrastrados fácilmente hasta las aguas superficiales, lo que tiene efectos muy negativos para la salud de las daphnia, peces, langostas y algas.
CARACTERÌSTICAS:
- Los bromuros orgánicos son también perjudiciales para los mamíferos, especialmente cuando se acumulan en los cuerpos de sus presas. Los efectos más importantes sobre los animales son daños nerviosos y daños en el ADN, lo que puede aumentar las probabilidades de desarrollar cáncer.
- Los bromuros orgánicos no son muy biodegradables; cuando son descompuestos se forman bromuros inorgánicos. Éstos pueden dañar el sistema nervioso si son absorbidos en grandes dosis.
YODO(Y)

Elemento no metálico, símbolo I, número atómico 53, masa atómica relativa 126.904, el más pesado de los halógenos (halogenuros) que se encuentran en la naturaleza. En condiciones normales, el yodo es un sólido negro, lustroso, y volátil; recibe su nombre por su vapor de color violeta.
Descubridor: Bernard Courtois.Lugar de descubrimiento: Francia.
Año de descubrimiento: 1811.
Origen del nombre: De la palabra griega "iodes" que significa "violeta", aludiendo al color de los vapores del yodo.
Efecto ambiental: El yodo puede ser radioactivo. Los isótopos radioactivos se forman de manera natural durante reacciones químicas en la atmósfera. La mayoría de los isótopos radioactivos del yodo tienen unas vidas medias muy cortas y se transformarán rápidamente en compuestos estables de yodo. Sin embargo, hay una forma radioactiva del yodo que tiene una vida media de millones de años y que es seriamente perjudicial para el medio ambiente. Este isótopo entra en el aire desde las plantas de energía nuclear, donde se forma durante el procesamiento del uranio y el plutonio. Los accidentes en las plantas nucleares han provocado la emisión de grandes cantidades de yodo radioactivo al aire.
CARACTERISTICAS:
- El yodo parece ser un elemento que, en cantidades muy pequeñas, es esencial para la vida animal y vegetal.
- El yoduro y el yodato que se encuentran en las aguas marinas entran en el ciclo metabólico de la mayor parte de la flora y la fauna marinas, mientras que en los mamíferos superiores el yodo se concentra en la glándula tiroides, allí se convierte en aminoácidos yodados (principalmente tiroxina y yodotirosinas). Éstos se encuentran almacenados en la tiroides como tiroglobulina y, aparentemente, la tiroxina es secretada por la glándula.
- La deficiencia de yodo en los mamíferos lleva al bocio, una condición en que la glándula tiroides crece más de lo normal.
ASTATO (At)
Elemento químico con símbolo At y número atómico 85. El ástato es el elemento más pesado del grupo de los halógenos, ocupa el lugar debajo del yodo en el grupo VII de la tabla periódica. El ástato es un elemento muy inestable, que existe sólo en formas radiactivas de vida corta. Se han preparado unos 25 isótopos mediante reacciones nucleares de transmutación artificial.
Descubridor: Dale Corson, K. MacKenzie, Emilio Segrè.
Lugar de descubrimiento: USA.
Año de descubrimiento: 1940.
Origen del nombre: De la palabra griega "astatos" que significa "inestable", debido a que este elemento carecía de isótopos estables.
Efecto ambiental: El Ástato no se da en cantidades significativas en la biosfera, así que normalmente nunca presenta riesgos
Lugar de descubrimiento: USA.
Año de descubrimiento: 1940.
Origen del nombre: De la palabra griega "astatos" que significa "inestable", debido a que este elemento carecía de isótopos estables.
Efecto ambiental: El Ástato no se da en cantidades significativas en la biosfera, así que normalmente nunca presenta riesgos
CARACTERISTICAS:
- En solución acuosa, el ástato tiene propiedades similares al yodo excepto por las diferencias atribuibles al hecho de que las soluciones de ástato son, por necesidad, muy diluidas.
- Al igual que el halógeno yodo, se extrae con benceno cuando se halla como elemento libre en solución.
- El elemento en solución es reducido por agentes como el dióxido de azufre y es oxidado por bromo.
- Es el menos electronegativo de todos los halógenos. Tiene estados de oxidación con características de coprecipitación semejantes a las del ion yoduro, yodo libre y del ion yodato.
- Agentes oxidantes fuertes producen el ion astatato, pero no el ion perastatato. Es más fácil obtenerlo y caracterizarlo en estado libre por su alta volatilidad y facilidad de extracción con disolvente orgánicos.
WEBGRAFIA:
- https://www.youtube.com/watch?v=sZ1Qh7ivc-E
- https://www.youtube.com/watch?v=b4LFolL4QxM
- https://www.youtube.com/watch?v=sbzClgkK__o
- https://www.youtube.com/watch?v=SDzZca5r1ds
- https://www.youtube.com/watch?v=cnCFErGwWLc
- https://www.youtube.com/watch?v=xbpwDxAT6pw
- https://www.youtube.com/watch?v=2KL1AZwbVRo
- https://www.youtube.com/watch?v=di0jSLWnypM
- https://www.youtube.com/watch?v=2HMAmn1BedA

BUEN TRABAJO 4,5
ResponderEliminar